CORRECCIÓN BLOG: NIVELACIÓN PH
En esta ocasión nos centraremos en el tema de potencial hidrógeno o conocido más como PH, para ello realizaremos un laboratorio en el cual podremos observar y practicar sus diversas aplicaciones y conceptos vitales para realizar los ejercicios correctamente.
JUSTIFICACIÓN
El siguiente blog será de aprendizaje, es decir una forma práctica para que el alumno aprenda y demuestre sus conocimientos por medio de actividades y ejemplos claros sobre el PH.
OBJETIVOS
· Dar a entender los temas propuestos
· Explicar de manera más amplia los temas
· Ver como se aplica el PH
· Saber en qué momento es cada sustancia
· A media de que se realicen los ejercicios más dudas se van a aclarar.
· Adquirir conocimientos básicos.
MARCO TEÓRICO
¿QUE ES PH?
El pH es una medida de la acidez y de la alcalinidad de una sustancia. Tiene un rango que va desde 0 a 14. Una sustancia con pH entre 0 y 7 es una sustancia ácida y una sustancia entre 7 y 14 es una sustancia alcalina. El agua potable tiene un pH entre 6 y 9. Fuera de esos valores sería perjudicial para la salud, puesto que sería corrosiva. Cuando 2 sustancias tienen diferente pH (siendo una ácida y la otra alcalina) crean una reacción. Uno de los productos conocidos más ácidos sería el ácido clorhídrico (con pH menor de 1) y uno de los más alcalinos que conocemos sería la lejía (con pH cercano a 14).
El PH es el Potencial de Hidrógeno. Es una medida para determinar el grado de alcalinidad o acidez de una disolución. Con el PH determinamos la concentración de hidrogeniones en una disolución. Un hidrogenión es un ion positivo de Hidrógeno, es un “cachito con carga positiva” del Hidrógeno.
La fórmula matemática para calcular el PH es el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. PH = –log [aH+].
Es decir, será más ácido cuantos más actividad de “cachitos con cargas positivas” de Hidrógeno exista en la disolución. Cuando haya menos actividad la muestra, será alcalina.
Importancia
El índice de la escala de pH es muy importante en procesos químicos, biológicos, industriales y en general en la vida cotidiana. La diferencia entre la lluvia normal y la lluvia ácida sólo se expresa a través del pH. El pH no sólo sirve como índice de contaminación del agua de lluvia y como diagnóstico para una enfermedad corporal (al medir el pH de la orina o de la sangre), sino que además nos puede indicar el grado de contaminación de un terreno.
El control del pH en procesos químicos industriales también tiene importancia y llega a ser capital, por ejemplo, en el proceso de elaboración de la cerveza, que sólo puede generarse bajo las condiciones de un pH ácido. Para poder mantener un control adecuado del pH en este tipo de procesos es sumamente importante contar con indicadores confiables.
En FARBE cuenta con indicadores de pH como la antocianina y el rojo de metilo, entre otros, así como con una gran variedad de colorantes naturales para la industria farmacéutica, alimenticia y textil.
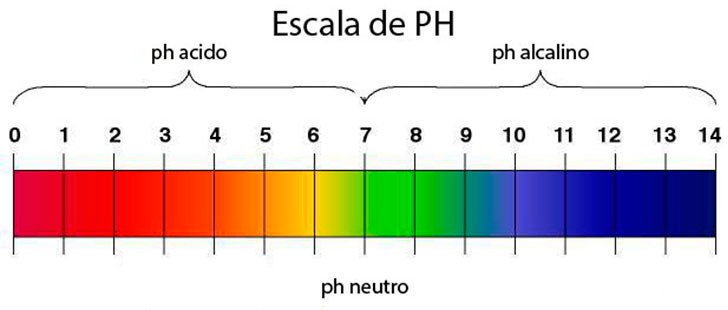
Escala de ph
La escala del pH es una escala numérica que va de 0 a 14. El conocimiento de la escala es fundamental para poder trabajar con el pH. Aquí puedes ver la escala del pH. Verás que es una escala que va del 1 al 14, donde entre el 1 y el 7 corresponden al pH ácido y entre 7 y 14 al pH alcalino. Los productos ácidos son aquellos productos que van a tener un pH menor que 7, ya sea ácido cítrico, bórico o cualquier tipo de ácido.
Medición de ph
El nivel de pH de las sustancias es determinante para que muchas reacciones se lleven a cabo, tanto en los procesos internos de los seres vivos como en la preparación de productos que utilizamos en nuestra vida cotidiana y su comportamiento al contacto con diferentes medios. Por ejemplo, la sangre de los humanos tiene un pH que se encuentra entre 7,35 y 7,45 y fuera de este rango ideal las funciones vitales pueden sufrir alteraciones que nos provoquen hasta la muerte. Conociendo el pH de los alimentos podemos saber si es seguro ingerirlos o no, pues es un valor que refleja si se encuentran en buenas condiciones o si son apropiados para el consumo humano sin representar un riesgo para la salud. De la misma manera, en diferentes procesos industriales como en el teñido de textiles, conocer y controlar el nivel de pH de las sustancias que se utilicen asegurarán el éxito del proceso. Existen diversas formas de medición del pH. Desde aparatos sencillos y caseros, tiras de medición, y también indicadores de medida. Según el grado de precisión que quieras obtener (y presupuesto y tiempo que vas a dedicar a la medición del pH), tienes diversas formas de medida del pH. En este apartado puedes encontrar toda la información relativa a los medidores de pH.
Medidores de pH. Hoy en día encontrarás múltiples tablas y valores en Internet con muchísimos valores típicos del pH. No obstante el conocer cómo medir el pH, y poderlo aplicar es una técnica que nunca te va a faltar. Desde el pH en el agua de la piscina, hasta conocer el pH en el grifo de tu casa. Si quieres hacer jabones, cremas, cultivar plantas,… medir el pH va a ser fundamental. Aquí te presentamos algunos medidores de pH sencillos, como los ph-metros o los indicadores de pH, rojo fenol, fenolftaleína, azul de metileno…
PH en el cuerpo:
Depende, y decimos depende porque cada parte del cuerpo suele tener un PH diferente. Nuestro cuerpo está continuamente generando hidrogeniones. Ponemos algunos ejemplos:
Sangre:
Suele estar entre 7,35 y 7,45. Por encima o debajo de estos valores, tendríamos algún problema de salud.
Piel:
Suele tener un PH de 5,5.
Jugos Gástricos:
Su PH suele tener un valor de 1,5.
El Ph del líquido extracelular (como la sangre) es ligeramente alcalino. Nuestro cuerpo no puede permitirse cambios bruscos en el PH extracelular por ello existen mecanismos para proteger nuestro organismo y mantenerlo estable.
¿Qué es un indicador de pH?
Los indicadores de pH son fundamentales para determinar la cantidad de pH que se encuentra en un medio específico. Cuando se habla del concepto de pH, este representa la concentración de iones de hidronio (H3O+) que se encuentra presente en una solución acuosa.
Asimismo, se mide en una escala logarítmica negativa entre 0 y 14, donde las soluciones con pH menores a 7 se consideran ácidas, las de pH mayores a 7 son básicas y las de pH igual a 7 se consideran soluciones neutras. Este parámetro se expresa de la siguiente manera con la ecuación de Henderson-Hasselbalch: pH = pKa + log10 ([A–]/ [HA]).
En la expresión anterior, el pKa representa el logaritmo negativo de la constante de disociación de ácidos, y las concentraciones molares [A–] y [HA] son las del ácido débil y su base conjugada, respectivamente. Conocer el pH permite estudiar la calidad del agua y los alimentos, y poder mantener la respetabilidad de un producto químico elaborado.
Tipos
Existen tres tipos principales de indicadores de pH: indicadores líquidos ácido-base, que funcionan según un rango determinado de pH; los papeles y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie; y los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
Existen tres tipos principales de indicadores de pH: indicadores líquidos ácido-base, que funcionan según un rango determinado de pH; los papeles y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie; y los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
-Indicadores líquidos: Los indicadores líquidos son ácidos o bases orgánicas débiles que poseen colores variantes según su forma ácida o básica. Estos trabajan dentro de rangos limitados, variando de color una vez se alcanza este, y dejando de variar el color cuando se alcanza el nivel máximo del rango.
Para que funcionen deben ser usados únicamente en soluciones donde se pueda observar un cambio de color (preferiblemente incoloras).
Existe un gran número de indicadores líquidos de distintos colores y rangos de pH, incluyendo el rojo de cresol (rojo a amarillo en un rango de 0,2 a 1,8), el rojo de metilo (rojo a amarillo en un rango de 4,2 a 6,2), verde bromocresol (rosado a azul/verde de 4,2 a 5,2), y la fenolftaleína (incolora a rosada en un rango de 8,0 a 10,0).
Estos indicadores son populares para las titulaciones en la química analítica, aunque se debe tener cierto nivel de entrenamiento para llevar a cabo esta práctica de manera precisa.
-Papeles indicadores: Existen varios tipos de papeles utilizados para la medición del pH, pero el más conocido es el llamado papel tornasol, el cual es elaborado con un polvo que proviene de líquenes.
El papel tornasol sirve para conocer si una solución líquida o gaseosa es ácida o básica (sin saber cuál será su pH exacto o un estimado del mismo), y viene en dos presentaciones: azul y rojo. El papel tornasol azul cambia a rojo en condiciones ácidas, y el papel tornasol rojo cambia a azul en condiciones básicas o alcalinas, pudiendo reciclarse para realizar la prueba de manera inversa una vez el papel ya haya cambiado el color.
Las limitaciones conocidas del papel (como su incapacidad de ofrecer un valor exacto o estimado del pH y la habilidad de cambiar a otros colores cuando reacciona con ciertos compuestos) han hecho que haya sido reemplazado por los indicadores líquidos y/o pH-metros.
pH-metros .Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos. Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
Las limitaciones conocidas del papel (como su incapacidad de ofrecer un valor exacto o estimado del pH y la habilidad de cambiar a otros colores cuando reacciona con ciertos compuestos) han hecho que haya sido reemplazado por los indicadores líquidos y/o pH-metros.
pH-metros .Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos. Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
El funcionamiento de estos medidores de pH se explica con más profundidad en la sección siguiente, pero en general estos indicadores se consideran los más precisos por excelencia, brindando un número preciso (a la exactitud de 0,01 unidades de pH) del parámetro y contando con una sensibilidad y rapidez superior a los otros dos métodos.
Además, también pueden medir otras características, como sólidos disueltos, conductividad eléctrica y temperatura de la solución. La única desventaja de este tipo de medidores de pH es que son equipos delicados y, además de una calibración inicial que debe realizar un instrumentista o conocedor del equipo, también necesitarán ser limpiados regularmente para evitar que los electrodos sufran acumulación de material en estos.
Características de PH:
La sigla pH significa Potencial de Hidrógeno, y consiste en un índice que indica la acidez, neutralidad o alcalinidad de un medio cualquiera. El pH es una característica de todas las sustancias determinadas por la concentración de iones de hidrógeno (H +). Cuanto menor es el pH de una sustancia, mayor es la concentración de iones H + y menor la concentración de iones OH-.
Según Arrhenius, un medio que presenta hidronios es ácido, y el que presenta hidróxidos es básico. Sin embargo, debemos relacionar la cantidad de ambos iones (H + y OH-), lo que hace que la clasificación de un medio siga estos principios:
- · Medio ácido: concentración de hidronios> (mayor) que la de hidróxidos.
- · Medio neutro: concentración de hidronios = (igual) a de hidróxidos.
- · Medio básico: concentración de hidronios < (menor) que la de hidróxidos.
Los valores de pH varían de 0 a 14, los valores por debajo de 0 y por encima de 14 son posibles, pero muy raros y no se pueden medir con los aparatos convencionales. Así, podemos clasificar un medio por medio del valor del pH de la siguiente manera:
Para pH = 7, el medio será neutro (indica que [H +] = [OH-]);
Para pH> 7, el medio será básico (indica que [H +] < [OH-]);
Para pH <7, el medio será ácido (indica que [H +]> [OH-]).
Las sustancias que poseen valores de pH 0 a 7, se consideran ácidas, valores en torno a 7 son neutras y valores por encima de 7 se denominan básicas o alcalinas. El pH de una sustancia puede variar según su composición, concentración de sales, metales, ácidos, bases y sustancias orgánicas y de la temperatura.
La escala del pH puede variar de 0 a 14, y cuanto menor sea el índice del pH de una sustancia, más ácida será esta sustancia.
Ejemplos:
Jugo de limón (pH 2)Jugo de naranja (pH 4)Jugo gástrico (pH 1)Cerveza (pH 5)Detergente (pH 10,5)Amoníaco (pH 12)Agua jabonosa (pH 9)Lejía (pH 13)Agua de mar (pH 8)Refresco de cola (pH 3)Agua de cal (pH 11)Ácido clorhídrico (pH 0)Leche de magnesia (pH 10)Batería (pH 1)Piel humana (pH 5,5)Hidróxido de sodio (pH 14)Leche (pH 6)Agua pura (pH 7)Vinagre (pH 3)Sangre (pH 8)
Indicadores ph
Un indicador de pH es una sustancia que permite medir el pH de un medio. Habitualmente, se utilizan como indicador a sustancias químicas que cambian su color al cambiar el pH de la disolución.El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie. Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1-4,4, de color rojo a naranja, y la fenolftaleína, que varía desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados/violetas. Además se pueden usar indicadores caseros como la disolución resultante de hervir con agua col lombarda (repollo colorado), pétalos de rosa roja, raíces de cúrcuma a partir de las cuales se obtiene curcumina, y otros(entre los cuales podemos destacar a la col morada y la piel de ciruela, que son usadas por algunas culturas indígenas).
Tipos de indicadores y características
Un electrodo de pH, puede ser considerado como la batería del mismo medidor, pues este tiene una tensión que varía dependiendo del pH de la sustancia que se está midiendo.
Este electrodo, es un bulbo que está elaborado de vidrio, este material es ultra sensible al contacto con los iones de hidrógeno, cuenta con una salida de milivoltios que registra una serie de alteraciones al registrar la concentración de los iones, midiendo así el tipo de pH.
Este electrodo continúa estable mientras los iones de hidrógenos no cambien de actividad ni de concentración.
Este electrodo, cuenta también con una resistencia que tiene una gran potencia, la cual, dificulta, en cierta escala, la medida correcta de las variaciones del pH, en este caso, la impedancia de la entrada y la resistencia formada en el conjunto del medidor, forman una de las partes más importantes de este, por lo que debido a ellas el resultado jamás sería exacto.
Portátiles: Son muy exactos, compactos, funcionales y están elaborados con la mejor calidad, tienen la gran ventaja de poder colocarse en cualquier lugar y de manipularse en cualquier espacio del laboratorio o de la fábrica, son ideales para las industrias farmacéuticas, los laboratorios y dentro del campo de la biología o de la agricultura.
Componentes: Memoria de lectura y capacidad de almacenamiento de cada una de las medidas registradas, salida RS232, configuración manual o programada, unidades de temperatura en °C o °F, programa automático de encendido y apagado, timer, compensación de temperatura en modo automático.
Fijo: Ideales para las fábricas, los laboratorios y para los procesos de producción de los mismos, pues ofrecen un tipo de lectura en mv, en iones y en temperatura, las opciones de mando son muy fáciles de ejecutar y son ideales tanto para las empresas de pequeña producción que no requieren de un nivel de logística y de producción demasiado complicadas, como para las grandes industrias que generan toneladas de producción.
PH DE LA FENOFTALEINA
Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.
La fenolftaleína, de fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,2 (incoloro) y pH=10 (magenta o rosado). Sin embargo, en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración: la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna naranja.
PH DEL TORNASOL
El Papel tornasol o Papel pH es utilizado para medir la concentración de Iones Hidrógenos contenido en una sustancia o disolución. Mediante la escala de pH, la cual es clasificada en distintos colores y tipos. El papel tornasol se sumerge en soluciones y luego se retira para su comparación con la escala de pH.
Escala de pH
- · 1 al 6 : Ácido
- · 7 : Neutro
- · 8 al 14 : Base o Alcalino
PH UNIVERSAL
Es una solución formada por una mezcla de compuestos que presentan comportamiento de indicador ácido-base; permite medir la acidez o alcalinidad de un medio con el cambio de color al cambiar el pH de la disolución en un rango que va del 1 al 14. El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie de interés.
MARCO DE DESARROLLO
-Pantallazos del PH en Yenka
Primero utilizamos fenolftaleína
Ahora pasamos a universal
Y seguimos con tornasol
conclusiones:
De este trabajo podemos concluir que el pH se encuentra
en muchos elementos en nuestro diario vivir y que estos son estudiados mediante
los indicadores de pH en los que están: Universal, Tornasol y Fenolftaleína y
gracias a estos se puede medir la acidez y la alcalinidad de los
compuestos.
En el universal podemos notar un cambio de color cundo el ácido es mucho mayor que la base, en el tornasol se torna color rojo o anaranjado cuando son compuestos ácidos y en la Fenolftaleína normalmente en ácidos es incoloro pero en bases se torna de un color rosa.
WEB-GRAFÍA:













Comentarios
Publicar un comentario