CORRECCIÓN BLOG: NIVELACIÓN NEUTRALIZACION
NEUTRALIZACION
Como se puede observar en la reacción, la sal se forma entre el anión del (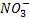 ) ácido y el catión (K+).
) ácido y el catión (K+).
WEB-GRAFÍA:
INTRODUCCIÓN
En esta ocasión nos centraremos en el tema de neutralizacion,para ello realizaremos un laboratorio en el cual podremos observar y practicar sus diversas aplicaciones y conceptos vitales para realizar los ejercicios correctamente.
JUSTIFICACIÓN
El siguiente blog será de aprendizaje, es decir una forma práctica para que el alumno aprenda y demuestre sus conocimientos por medio de actividades y ejemplos claros sobre las sales.
OBJETIVOS
· Dar a entender los temas propuestos
· Explicar de manera más amplia los temas
· Saber en qué momento es cada sustancia
· A media de que se realicen los ejercicios más dudas se van a aclarar.
· Adquirir conocimientos básicos.
MARCO TEÓRICO
¿QUE ES LA NEUTRALIZACION?
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua.
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una molécula de ácido con una molécula de la base para generar la sal. Pero no siempre es así.
2 NaOH + H2SO4 —-> Na2SO4 + 2 H20
Aquí se necesitan 2 moléculas de la base contra 1 del ácido para formar el sulfato de sodio.
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración acido base o titulación acido base. Por ejemplo, si se quiere averiguar la molaridad de un ácido se coloca a la solución de este en un Erlenmeyer y se la enfrenta con otra solución de un hidróxido de concentración exactamente conocida. Esta solución de la base se la coloca en una bureta quedando por encima del Erlenmeyer que tiene la solución problema del ácido. Colocamos una gota de un indicador en el Erlenmeyer para que nos indique el momento exacto en el cual se ha producido la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer haciendo movimientos suaves y circulares para una correcta titulación. Apenas vemos un cambio de coloración al rosa cesamos al agregado de la solución de hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y hacemos los cálculos correspondientes.
Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua.
La ecuación general que representa este tipo de reacción es:
Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) son:
Como se puede observar en la reacción, la sal se forma entre el anión del (
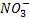 ) ácido y el catión (K+).
) ácido y el catión (K+).
Características:
En primer lugar, se debe enfatizar que si una reacción de neutralización se inicia con cantidades iguales del ácido y de la base (en moles), cuando finaliza dicha reacción se obtiene solamente una sal; es decir, no hay cantidades residuales de ácido o base.
Además, una propiedad muy importante de las reacciones ácido-base es el pH, el cual indica qué tan ácida o básica es una solución. Este se determina por la cantidad de iones H+ que se encuentran en las soluciones medidas.
Por otro lado, existen varios
conceptos de acidez y basicidad dependiendo de los parámetros que se tomen en
consideración. Un concepto que destaca es el de Brønsted y Lowry, que considera
un ácido como una especie capaz de donar protones (H+) y una base como la
especie capaz de aceptarlos.
Titulaciones ácido-base
Para estudiar apropiadamente y de
manera cuantitativa una reacción de neutralización entre un ácido y una base se
aplica una técnica llamada titulación (o valoración) ácido-base.
Las titulaciones ácido-base
consisten en determinar la concentración de ácido o base necesaria para
neutralizar una cantidad determinada de base o ácido de concentración conocida.
En la práctica, se debe añadir
gradualmente una solución patrón (cuya concentración se conoce con exactitud) a
la solución cuya concentración se desconoce hasta que se alcance el punto de
equivalencia, donde una de las especies ha neutralizado de manera completa a la
otra.
El punto de equivalencia se detecta mediante el cambio violento de color del indicador que se ha añadido a la solución de concentración desconocida cuando se ha completado la reacción química entre ambas soluciones.
Por ejemplo, en el caso de la neutralización del ácido fosfórico (H3PO4) habrá un punto de equivalencia por cada protón que se desprenda del ácido; es decir, se tendrán tres puntos de equivalencia y se observarán tres cambios de coloración.
Ejemplos:
Considere los siguientes ejemplos de varios tipos de reacciones de neutralización:
Acido + base -----sal + agua
Esta reacción también se puede considerar como una reacción de doble desplazamiento en la que el ion hidrógeno del ácido se combina con el ion hidroxilo de la base para formar agua. Esto deja al ion sodio y al ion cloruro en la solución, la cual es una solución acuosa de cloruro de sodio. Para que se pueda visualizar que la reacción se llevó a cabo (ya que las dos soluciones son incoloras), se utiliza un indicador de fenolftaleína que cambia a color rosado cuando se agrega inicialmente al ácido y a éste se le va agregando la base hasta terminar la reacción.
Oxido de metal (anhídrido básico) + ácido -----agua + sal
Oxido de metal + óxido de no metal ------sal
Como se indicó anteriormente en la unidad de reacciones de combinación, estas reacciones se pueden considerar como reacciones de neutralización. Puesto que el óxido del metal es un anhídrido básico y el óxido de un no metal es un anhídrido ácido, la combinación de éstos para formar la sal es realmente un tipo de reacción ácido-base. Una forma de predecir el producto formado en reacciones de este tipo es considerar cuál base o hidróxido el óxido de metal formaría es estuviera en agua y cuál ácido el óxido del no metal formaría si estuviera en agua. Luego decidiendo cuál sal pueden formar el ácido y la base se determina el producto.
Conceptos básicos a tener en cuenta:
Los ácidos fuertes, son aquellas sustancias que se disocian totalmente, cuando se disuelven en agua. Son ácidos fuertes el H2SO4, HCl, HNO3, etc.
PH= -log [H+] = -log [Ac. Fuerte]
Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba (OH)2, etc.
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba (OH)2, etc.
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
Productos de una reacción de neutralización:
En las reacciones de un ácido fuerte con una base fuerte se lleva a cabo la neutralización completa de las especies, como en la reacción entre el ácido clorhídrico y el hidróxido de bario:
2HCl(ac)
+ Ba(OH)2(ac) → BaCl2(ac) + 2H2O(l)
Así que no se generan iones H+ u
OH– en exceso, lo cual significa que el pH de las soluciones de electrolitos
fuertes que se han neutralizado está intrínsecamente relacionado con el
carácter ácido de sus reactantes.
Por el contrario, en el caso de
la neutralización entre un electrolito débil y uno fuerte (ácido fuerte + base
débil o ácido débil + base fuerte) se obtiene la disociación parcial del
electrolito débil y aparece la constante de disociación del ácido (Ka) o de la
base (Kb) débil, para determinar el carácter ácido o básico de la reacción neta
mediante el cálculo del pH.
Por ejemplo, se tiene la reacción
entre el ácido cianhídrico y el hidróxido de sodio:
HCN(ac) +
NaOH(ac) → NaCN(ac) + H2O(l)
En esta reacción el electrolito
débil no se ioniza notablemente en la solución, por lo que se representa la
ecuación iónica neta de la siguiente manera:
HCN(ac) +
OH–(ac) → CN–(ac) + H2O(l)
Esta se obtiene luego de escribir
la reacción con los electrolitos fuertes en su forma disociada (Na+(ac) +
OH–(ac) en el lado de los reactantes, y Na+(ac) + CN–(ac) en el lado de los
productos), donde solo el ion sodio es un espectador.
Finalmente, en el caso de la
reacción entre un ácido débil y una base débil no se produce dicha
neutralización. Esto se debe a que ambos electrolitos se disocian de manera
parcial, sin dar como resultado el agua y la sal esperadas.
Ejemplos:
Ácido
fuerte + base fuerte
Se tiene como ejemplo la reacción
dada entre el ácido sulfúrico y el hidróxido de potasio en medio acuoso, según
la siguiente ecuación:
H2SO4
(ac) + 2KOH (ac) → K2SO4 (ac) + 2H2O (l)
Puede observarse que tanto el
ácido como el hidróxido son electrolitos fuertes; por lo tanto, se ionizan
completamente en la solución. El pH de esta solución dependerá del electrolito
fuerte que esté en mayor proporción.
A continuación se presentan dos
gráficas en las que se observa la titulación de la reacción de neutralización
de un ácido fuerte con una base fuerte y de una base fuerte con un ácido
fuerte, donde se representa también su punto de equivalencia:
Ácido fuerte + base débil
La neutralización del ácido
nítrico con el amoníaco da como resultado el compuesto nitrato de amonio, como
se muestra a continuación:
HNO3(ac)
+ NH3(ac) → NH4NO3(ac)
En este caso no se observa el
agua producida junto a la sal, debido a que se tendría que representar como:
HNO3(ac)
+ NH4+(ac) + OH–(ac) → NH4NO3(ac) + H2O(l)
De modo que sí puede observarse
el agua como producto de la reacción. En este caso, la solución tendrá un pH
esencialmente ácido.
Ácido débil + base fuerte
Seguidamente se muestra la
reacción que se da entre el ácido acético y el hidróxido de sodio:
CH3COOH
(ac) + NaOH (ac) → CH3COONa (ac) + H2O (l)
Como el ácido acético es un
electrolito débil se disocia parcialmente, dando como resultado acetato de
sodio y agua, cuya solución tendrá un pH básico.
Ácido débil + base débil
Por
último y como se dijo anteriormente, una base débil no puede neutralizar un
ácido débil; tampoco sucede al contrario. Ambas especies se hidrolizan en
solución acuosa y el pH de la solución dependerá de la “fuerza” del ácido y de
la base.
MARCO DE DESARROLLO
-Pantallazos de sales en Yenka
Ingresamos a la aplicación yenka y ponemos la carpeta de química inorgánica.
Entrar en la carpeta de ácidos, sales y bases.
Seleccionamos neutralización.
A continuación comenzaremos a resolver la actividad.
Aquí se mezcla el ácido clorhídrico más hidróxido de sodio esto produce agua más cloruro de sodio.
Aquí se mezcla el ácido nítrico más hidróxido de sodio que esto da agua más nitrato de sodio.
Aquí se mezcla ion sulfato ácido más ion sulfato más ion hidrógeno ácido sulfúrico más hidróxido de potasio esto produce agua más sulfato de potasio.
WEB-GRAFÍA:









Comentarios
Publicar un comentario