QUÍMICA INORGÁNICA
ÁCIDOS, SALES, BASES Y POTENCIAL HIDRÓGENO
INTRODUCCIÓN
En esta ocasión nos
centraremos en los temas de ácidos, sales, bases y potencial hidrógeno o
conocido más como PH, para ello realizaremos un laboratorio en el cual podremos
observar y practicar sus diversas aplicaciones y conceptos vitales para
realizar los ejercicios correctamente.
JUSTIFICACIÓN
El siguiente blog será de aprendizaje, es
decir una forma práctica para que el alumno aprenda y demuestre sus
conocimientos por medio de actividades y ejemplos claros sobre los ácidos,
sales, bases y el PH.
OBJETIVOS
·
Dar a entender los temas propuestos
·
Explicar de manera más amplia los temas
·
Ver como se aplica el PH
·
Saber en qué momento es cada sustancia
·
A media de que se realicen los ejercicios más dudas se van a aclarar.
·
Adquirir conocimientos básicos.
MARCO TEÓRICO
¿QUE ES LA QUÍMICA
INORGÁNICA?
La química
inorgánica es la rama de la química que estudia las propiedades, estructura y
re actividad de los compuestos inorgánicos. Este campo de la química
abarca todos los compuestos químicos descontando los que tienen enlaces
carbono-hidrógeno, que son objeto de estudio por parte de la química orgánica.
Ambas disciplinas comparten numerosos puntos en común, y están surgiendo campos indisciplinares de
gran importancia, entre los que podemos citar la química organometálica.
La parte más importante de los compuestos inorgánicos se
forman por combinación de cationes y aniones unidos por enlaces iónicos. Así,
el NaCl se forma por unión de cationes sodio con aniones cloruro. La facilidad
con la que se forma un compuesto iónico depende del potencial de ionización
(para el catión) y de la afinidad electrónica (para el anión) de los elementos
que generan los iones respectivos. Los compuestos inorgánicos más importantes
son los óxidos, carbonatos, sulfatos, etc. La mayor parte de los compuestos
inorgánicos se caracterizan por puntos de fusión elevados, baja conductividad
en estado sólido y una importante solubilidad en medio acuosa.
¿QUE ES LA NEUTRALIZACION?
La Neutralización ácido base es un proceso mediante
el cual un ácido reacciona con una base o hidróxido y da como resultado una sal
y agua.
La más común es la reacción de un ácido fuerte
contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar
casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el
hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una
molécula de ácido con una molécula de la base para generar la sal. Pero no
siempre es así.
2 NaOH + H2SO4 —-> Na2SO4 +
2 H20
Aquí se necesitan 2 moléculas de la base contra 1
del ácido para formar el sulfato de sodio.
Este principio se usa para averiguar la molaridad
de un ácido o de una base gracias a un procedimiento llamado valoración acido
base o titulación acido base. Por ejemplo, si se quiere averiguar la molaridad
de un ácido se coloca a la solución de este en un Erlenmeyer y se la enfrenta
con otra solución de un hidróxido de concentración exactamente conocida. Esta
solución de la base se la coloca en una bureta quedando por encima del Erlenmeyer
que tiene la solución problema del ácido. Colocamos una gota de un indicador en
el Erlenmeyer para que nos indique el momento exacto en el cual se ha producido
la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo
la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer
haciendo movimientos suaves y circulares para una correcta titulación. Apenas
vemos un cambio de coloración al rosa cesamos al agregado de la solución de
hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y
hacemos los cálculos correspondientes.
Se llama neutralización a la reacción que se
produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como
producto una sal y agua.
La ecuación
general que representa este tipo de reacción es:
Por
ejemplo, la reacción de neutralización que se produce entre el ácido
nítrico (HNO3) y el hidróxido de
potasio (KOH) son:
Como se puede observar en la reacción, la sal se forma entre el anión del (
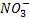 ) ácido y el catión (K+).
) ácido y el catión (K+).
Características:
En primer lugar, se debe enfatizar que si una reacción de neutralización se
inicia con cantidades iguales del ácido y de la base (en moles), cuando
finaliza dicha reacción se obtiene solamente una sal; es decir, no hay
cantidades residuales de ácido o base.
Además, una propiedad muy importante de las reacciones
ácido-base es el pH, el cual indica qué tan ácida o básica es una solución.
Este se determina por la cantidad de iones H+ que se encuentran en las
soluciones medidas.
Por otro lado, existen varios conceptos de acidez y basicidad dependiendo de
los parámetros que se tomen en consideración. Un concepto que destaca es el de
Brønsted y Lowry, que considera un ácido como una especie capaz de donar protones
(H+) y una base como la especie capaz de aceptarlos.
Titulaciones ácido-base
Para estudiar apropiadamente y de manera cuantitativa una reacción de
neutralización entre un ácido y una base se aplica una técnica llamada
titulación (o valoración) ácido-base.
Las titulaciones ácido-base consisten en determinar la concentración de ácido o
base necesaria para neutralizar una cantidad determinada de base o ácido de
concentración conocida.
En la práctica, se debe añadir gradualmente una solución patrón (cuya
concentración se conoce con exactitud) a la solución cuya concentración se
desconoce hasta que se alcance el punto de equivalencia, donde una de las
especies ha neutralizado de manera completa a la otra.
El punto de equivalencia se detecta mediante el cambio
violento de color del indicador que se ha añadido a la solución de
concentración desconocida cuando se ha completado la reacción química entre
ambas soluciones.
Por ejemplo, en el caso de la neutralización del ácido
fosfórico (H3PO4) habrá un punto de equivalencia por cada protón que se
desprenda del ácido; es decir, se tendrán tres puntos de equivalencia y se
observarán tres cambios de coloración.
Ejemplos:
Considere los siguientes ejemplos de varios tipos de
reacciones de neutralización:
Acido
+ base -----sal + agua
Esta reacción también se puede considerar como
una reacción de doble desplazamiento en la que el ion hidrógeno del ácido se
combina con el ion hidroxilo de la base para formar agua. Esto deja al ion
sodio y al ion cloruro en la solución, la cual es una solución acuosa de
cloruro de sodio. Para que se pueda visualizar que la reacción se llevó a cabo
(ya que las dos soluciones son incoloras), se utiliza un indicador de
fenolftaleína que cambia a color rosado cuando se agrega inicialmente al ácido
y a éste se le va agregando la base hasta terminar la reacción.
Oxido
de metal (anhídrido básico) + ácido -----agua + sal
Oxido
de metal + óxido de no metal ------sal
Como se indicó anteriormente en la unidad de reacciones
de combinación, estas reacciones se pueden considerar como reacciones de
neutralización. Puesto que el óxido del metal es un anhídrido básico y el óxido
de un no metal es un anhídrido ácido, la combinación de éstos para formar la
sal es realmente un tipo de reacción ácido-base. Una forma de predecir el
producto formado en reacciones de este tipo es considerar cuál base o hidróxido
el óxido de metal formaría es estuviera en agua y cuál ácido el óxido del no
metal formaría si estuviera en agua. Luego decidiendo cuál sal pueden formar el
ácido y la base se determina el producto.
Conceptos básicos a tener en cuenta:
Los ácidos
fuertes, son aquellas sustancias que se disocian totalmente, cuando se
disuelven en agua. Son ácidos fuertes el H2SO4, HCl, HNO3, etc.
PH= -log [H+] = -log [Ac. Fuerte]
Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba (OH)2, etc.
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba (OH)2, etc.
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
Productos
de una reacción de neutralización:
En
las reacciones de un ácido fuerte con una base fuerte se lleva a cabo la
neutralización completa de las especies, como en la reacción entre el ácido
clorhídrico y el hidróxido de bario:
2HCl(ac) + Ba(OH)2(ac) → BaCl2(ac) + 2H2O(l)
Así que no se generan iones H+ u OH– en exceso, lo cual significa que el pH de
las soluciones de electrolitos fuertes que se han neutralizado está
intrínsecamente relacionado con el carácter ácido de sus reactantes.
Por el contrario, en el caso de la neutralización entre un electrolito débil y
uno fuerte (ácido fuerte + base débil o ácido débil + base fuerte) se obtiene
la disociación parcial del electrolito débil y aparece la constante de
disociación del ácido (Ka) o de la base (Kb) débil, para determinar el carácter
ácido o básico de la reacción neta mediante el cálculo del pH.
Por ejemplo, se tiene la reacción entre el ácido cianhídrico y el hidróxido de
sodio:
HCN(ac) + NaOH(ac) → NaCN(ac) + H2O(l)
En esta reacción el electrolito débil no se ioniza notablemente en la solución,
por lo que se representa la ecuación iónica neta de la siguiente manera:
HCN(ac) + OH–(ac) → CN–(ac) + H2O(l)
Esta se obtiene luego de escribir la reacción con los electrolitos fuertes en
su forma disociada (Na+(ac) + OH–(ac) en el lado de los reactantes, y Na+(ac) +
CN–(ac) en el lado de los productos), donde solo el ion sodio es un espectador.
Finalmente, en el caso de la reacción entre un ácido débil y una base débil no
se produce dicha neutralización. Esto se debe a que ambos electrolitos se
disocian de manera parcial, sin dar como resultado el agua y la sal esperadas.
Ejemplos:
Ácido fuerte + base fuerte
Se tiene como ejemplo la reacción dada entre el ácido sulfúrico y el hidróxido
de potasio en medio acuoso, según la siguiente ecuación:
H2SO4 (ac) + 2KOH (ac) → K2SO4 (ac) + 2H2O (l)
Puede observarse que tanto el ácido como el hidróxido son electrolitos fuertes;
por lo tanto, se ionizan completamente en la solución. El pH de esta solución
dependerá del electrolito fuerte que esté en mayor proporción.
A continuación se presentan dos gráficas en las que se observa la titulación de
la reacción de neutralización de un ácido fuerte con una base fuerte y de una
base fuerte con un ácido fuerte, donde se representa también su punto de
equivalencia:
Ácido fuerte + base débil
La neutralización del ácido nítrico con el amoníaco da como resultado el
compuesto nitrato de amonio, como se muestra a continuación:
HNO3(ac) + NH3(ac) → NH4NO3(ac)
En este caso no se observa el agua producida junto a la sal, debido a que se
tendría que representar como:
HNO3(ac) + NH4+(ac) + OH–(ac) → NH4NO3(ac) + H2O(l)
De modo que sí puede observarse el agua como producto de la reacción. En este
caso, la solución tendrá un pH esencialmente ácido.
Ácido débil + base fuerte
Seguidamente se muestra la reacción que se da entre el ácido acético y el
hidróxido de sodio:
CH3COOH (ac) + NaOH (ac) → CH3COONa (ac) + H2O (l)
Como el ácido acético es un electrolito débil se disocia parcialmente, dando
como resultado acetato de sodio y agua, cuya solución tendrá un pH básico.
Ácido débil + base débil
Por último y como se dijo anteriormente, una base débil no puede neutralizar un
ácido débil; tampoco sucede al contrario. Ambas especies se hidrolizan en
solución acuosa y el pH de la solución dependerá de la “fuerza” del ácido y de
la base.
¿QUE ES PH?
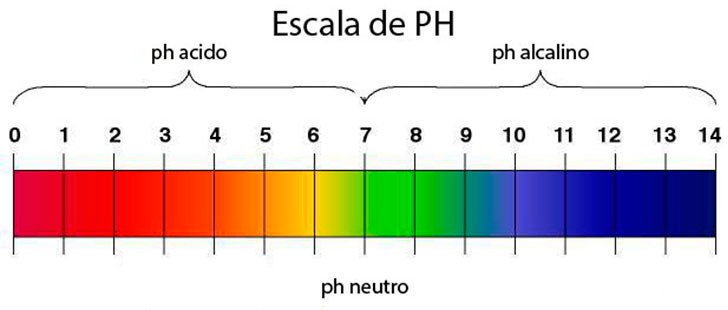
El pH es una medida de la
acidez y de la alcalinidad de una sustancia. Tiene un rango que va desde 0 a
14. Una sustancia con pH entre 0 y 7 es una sustancia ácida y una sustancia
entre 7 y 14 es una sustancia alcalina. El agua potable tiene un pH entre 6 y
9. Fuera de esos valores sería perjudicial para la salud, puesto que sería
corrosiva. Cuando 2 sustancias tienen diferente pH (siendo una ácida y la otra
alcalina) crean una reacción. Uno de los productos conocidos más ácidos sería
el ácido clorhídrico (con pH menor de 1) y uno de los más alcalinos que
conocemos sería la lejía (con pH cercano a 14).
El PH es el Potencial de
Hidrógeno. Es una medida para determinar el grado de alcalinidad o acidez de una
disolución. Con el PH determinamos la concentración de hidrogeniones en una
disolución. Un hidrogenión es un ion positivo de Hidrógeno, es un “cachito con
carga positiva” del Hidrógeno.
La fórmula matemática para
calcular el PH es el logaritmo negativo en base 10 de la actividad de los iones
hidrógeno. PH = –log [aH+].
Es decir, será más ácido cuantos más actividad de “cachitos
con cargas positivas” de Hidrógeno exista en la disolución. Cuando haya menos
actividad la muestra, será alcalina.
Importancia
El índice de la escala de pH es muy importante en
procesos químicos, biológicos, industriales y en general en la vida cotidiana.
La diferencia entre la lluvia normal y la lluvia ácida sólo se expresa a través
del pH. El pH no sólo sirve como índice de contaminación del agua de lluvia y
como diagnóstico para una enfermedad corporal (al medir el pH de la orina o de
la sangre), sino que además nos puede indicar el grado de contaminación de un
terreno.
El control del pH en procesos químicos industriales también
tiene importancia y llega a ser capital, por ejemplo, en el proceso de
elaboración de la cerveza, que sólo puede generarse bajo las condiciones de un
pH ácido. Para poder mantener un control adecuado del pH en este tipo de
procesos es sumamente importante contar con indicadores confiables.
En FARBE cuenta con indicadores de pH como la
antocianina y el rojo de metilo, entre otros, así como con una gran variedad de
colorantes naturales para la industria farmacéutica, alimenticia y textil.
Escala
de ph
La escala del pH es una escala numérica que va de 0 a 14.
El conocimiento de la escala es fundamental para poder trabajar con el pH. Aquí
puedes ver la escala del pH. Verás que es una escala que va del 1 al 14, donde
entre el 1 y el 7 corresponden al pH ácido y entre 7 y 14 al pH alcalino. Los
productos ácidos son aquellos productos que van a tener un pH menor que 7, ya
sea ácido cítrico, bórico o cualquier tipo de ácido.
Medición
de ph
El nivel de pH de las sustancias es determinante para que
muchas reacciones se lleven a cabo, tanto en los procesos internos de los seres
vivos como en la preparación de productos que utilizamos en nuestra vida
cotidiana y su comportamiento al contacto con diferentes medios. Por ejemplo,
la sangre de los humanos tiene un pH que se encuentra entre 7,35 y 7,45 y fuera
de este rango ideal las funciones vitales pueden sufrir alteraciones que nos
provoquen hasta la muerte. Conociendo el pH de los alimentos podemos saber si
es seguro ingerirlos o no, pues es un valor que refleja si se encuentran en
buenas condiciones o si son apropiados para el consumo humano sin representar
un riesgo para la salud. De la misma manera, en diferentes procesos
industriales como en el teñido de textiles, conocer y controlar el nivel de pH
de las sustancias que se utilicen asegurarán el éxito del proceso. Existen
diversas formas de medición del pH. Desde aparatos sencillos y caseros, tiras
de medición, y también indicadores de medida. Según el grado de precisión que
quieras obtener (y presupuesto y tiempo que vas a dedicar a la medición del
pH), tienes diversas formas de medida del pH. En este apartado puedes encontrar
toda la información relativa a los medidores de pH.
Medidores de pH. Hoy en día encontrarás múltiples tablas
y valores en Internet con muchísimos valores típicos del pH. No obstante el
conocer cómo medir el pH, y poderlo aplicar es una técnica que nunca te va a
faltar. Desde el pH en el agua de la piscina, hasta conocer el pH en el grifo
de tu casa. Si quieres hacer jabones, cremas, cultivar plantas,… medir el pH va
a ser fundamental. Aquí te presentamos algunos medidores de pH sencillos, como
los ph-metros o los indicadores de pH, rojo fenol, fenolftaleína, azul de
metileno…
PH
en el cuerpo:
Depende, y decimos depende porque cada parte del cuerpo
suele tener un PH diferente. Nuestro cuerpo está continuamente generando
hidrogeniones. Ponemos algunos ejemplos:
Sangre:
Suele estar entre 7,35 y 7,45. Por encima
o debajo de estos valores, tendríamos algún problema de salud.
Piel:
Suele tener un PH de 5,5.
Jugos Gástricos:
Su PH suele tener un valor de 1,5.
El Ph del líquido extracelular (como la sangre) es
ligeramente alcalino. Nuestro cuerpo no puede permitirse cambios bruscos en el
PH extracelular por ello existen mecanismos para proteger nuestro organismo y
mantenerlo estable.
¿Qué es un indicador de
pH?
Los indicadores de pH son fundamentales para determinar la cantidad de pH que se encuentra en un medio específico. Cuando se habla del concepto de pH, este representa la concentración de iones de hidronio (H3O+) que se encuentra presente en una solución acuosa.
Asimismo, se mide en una escala logarítmica negativa entre 0 y 14, donde las soluciones con pH menores a 7 se consideran ácidas, las de pH mayores a 7 son básicas y las de pH igual a 7 se consideran soluciones neutras. Este parámetro se expresa de la siguiente manera con la ecuación de Henderson-Hasselbalch: pH = pKa + log10 ([A–]/ [HA]).
En la expresión anterior, el pKa representa el logaritmo negativo de la constante de disociación de ácidos, y las concentraciones molares [A–] y [HA] son las del ácido débil y su base conjugada, respectivamente. Conocer el pH permite estudiar la calidad del agua y los alimentos, y poder mantener la respetabilidad de un producto químico elaborado.
Tipos
Existen tres tipos principales de indicadores de pH: indicadores líquidos ácido-base, que funcionan según un rango determinado de pH; los papeles y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie; y los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
Existen tres tipos principales de indicadores de pH: indicadores líquidos ácido-base, que funcionan según un rango determinado de pH; los papeles y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie; y los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
-Indicadores líquidos: Los indicadores líquidos son ácidos o bases orgánicas débiles que poseen colores variantes según su forma ácida o básica. Estos trabajan dentro de rangos limitados, variando de color una vez se alcanza este, y dejando de variar el color cuando se alcanza el nivel máximo del rango.
Para que funcionen deben ser usados únicamente en soluciones donde se pueda observar un cambio de color (preferiblemente incoloras).
Existe un gran número de indicadores líquidos de distintos colores y rangos de pH, incluyendo el rojo de cresol (rojo a amarillo en un rango de 0,2 a 1,8), el rojo de metilo (rojo a amarillo en un rango de 4,2 a 6,2), verde bromocresol (rosado a azul/verde de 4,2 a 5,2), y la fenolftaleína (incolora a rosada en un rango de 8,0 a 10,0).
Estos indicadores son populares para las titulaciones en la química analítica, aunque se debe tener cierto nivel de entrenamiento para llevar a cabo esta práctica de manera precisa.
-Papeles
indicadores: Existen varios tipos de papeles utilizados
para la medición del pH, pero el más conocido es el llamado papel tornasol, el
cual es elaborado con un polvo que proviene de líquenes.
El papel tornasol sirve para conocer si una solución
líquida o gaseosa es ácida o básica (sin saber cuál será su pH exacto o un
estimado del mismo), y viene en dos presentaciones: azul y rojo. El papel
tornasol azul cambia a rojo en condiciones ácidas, y el papel tornasol rojo
cambia a azul en condiciones básicas o alcalinas, pudiendo reciclarse para
realizar la prueba de manera inversa una vez el papel ya haya cambiado el
color.
Las limitaciones conocidas del papel (como su incapacidad de ofrecer un valor exacto o estimado del pH y la habilidad de cambiar a otros colores cuando reacciona con ciertos compuestos) han hecho que haya sido reemplazado por los indicadores líquidos y/o pH-metros.
pH-metros .Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos. Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
Las limitaciones conocidas del papel (como su incapacidad de ofrecer un valor exacto o estimado del pH y la habilidad de cambiar a otros colores cuando reacciona con ciertos compuestos) han hecho que haya sido reemplazado por los indicadores líquidos y/o pH-metros.
pH-metros .Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos. Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
El funcionamiento de estos medidores de pH se explica con
más profundidad en la sección siguiente, pero en general estos indicadores se
consideran los más precisos por excelencia, brindando un número preciso (a la
exactitud de 0,01 unidades de pH) del parámetro y contando con una sensibilidad
y rapidez superior a los otros dos métodos.
Además, también pueden medir otras características, como
sólidos disueltos, conductividad eléctrica y temperatura de la solución. La
única desventaja de este tipo de medidores de pH es que son equipos delicados
y, además de una calibración inicial que debe realizar un instrumentista o
conocedor del equipo, también necesitarán ser limpiados regularmente para
evitar que los electrodos sufran acumulación de material en estos.
Características de
PH:
La sigla pH significa Potencial de Hidrógeno, y
consiste en un índice que indica la acidez, neutralidad o alcalinidad de un
medio cualquiera. El pH es una característica de todas las sustancias
determinadas por la concentración de iones de hidrógeno (H +). Cuanto
menor es el pH de una sustancia, mayor es la concentración de iones H + y menor
la concentración de iones OH-.
Según Arrhenius, un medio que presenta hidronios es
ácido, y el que presenta hidróxidos es básico. Sin embargo, debemos relacionar
la cantidad de ambos iones (H + y OH-), lo que hace que la clasificación de un
medio siga estos principios:
- · Medio ácido: concentración de hidronios> (mayor) que la de hidróxidos.
- · Medio neutro: concentración de hidronios = (igual) a de hidróxidos.
- · Medio básico: concentración de hidronios < (menor) que la de hidróxidos.
Los valores de pH varían de 0 a 14, los valores por
debajo de 0 y por encima de 14 son posibles, pero muy raros y no se pueden
medir con los aparatos convencionales. Así, podemos clasificar un medio por
medio del valor del pH de la siguiente manera:
Para pH = 7, el medio será neutro (indica que
[H +] = [OH-]);
Para pH> 7, el medio será básico (indica que
[H +] < [OH-]);
Para pH <7, el medio será ácido (indica que
[H +]> [OH-]).
Las sustancias que poseen valores de pH 0 a 7, se
consideran ácidas, valores en torno a 7 son neutras y valores por encima de 7
se denominan básicas o alcalinas. El pH de una sustancia puede variar según su
composición, concentración de sales, metales, ácidos, bases
y sustancias orgánicas y de la temperatura.
La escala del pH puede variar de 0 a 14, y cuanto menor
sea el índice del pH de una sustancia, más ácida será esta sustancia.
Ejemplos:
Jugo de limón (pH 2)Jugo de naranja (pH 4)Jugo gástrico
(pH 1)Cerveza (pH 5)Detergente (pH 10,5)Amoníaco (pH 12)Agua jabonosa (pH
9)Lejía (pH 13)Agua de mar (pH 8)Refresco de cola (pH 3)Agua de cal (pH
11)Ácido clorhídrico (pH 0)Leche de magnesia (pH 10)Batería (pH 1)Piel humana
(pH 5,5)Hidróxido de sodio (pH 14)Leche (pH 6)Agua pura (pH 7)Vinagre (pH
3)Sangre (pH 8)
Indicadores ph
Un indicador de pH es una sustancia que permite medir el
pH de un medio. Habitualmente, se utilizan como indicador a sustancias químicas
que cambian su color al cambiar el pH de la disolución.El cambio de color se
debe a un cambio estructural inducido por la protonación o desprotonación de la
especie. Los indicadores Ácido-base tienen un intervalo de viraje de una unidad
arriba y otra abajo de pH, en la que cambian la disolución en la que se
encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en
el intervalo de pH 3,1-4,4, de color rojo a naranja, y la fenolftaleína, que
varía desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en
disoluciones con colores rosados/violetas. Además se pueden usar indicadores
caseros como la disolución resultante de hervir con agua col lombarda (repollo
colorado), pétalos de rosa roja, raíces de cúrcuma a partir de las cuales se
obtiene curcumina, y otros(entre los cuales podemos destacar a la col morada y
la piel de ciruela, que son usadas por algunas culturas indígenas).
Tipos de indicadores y características
Un electrodo de pH, puede ser considerado como la batería
del mismo medidor, pues este tiene una tensión que varía dependiendo del pH de
la sustancia que se está midiendo.
Este electrodo, es un bulbo que está elaborado de vidrio,
este material es ultra sensible al contacto con los iones de hidrógeno, cuenta
con una salida de milivoltios que registra una serie de alteraciones al
registrar la concentración de los iones, midiendo así el tipo de pH.
Este electrodo continúa estable mientras los iones de
hidrógenos no cambien de actividad ni de concentración.
Este electrodo, cuenta también con una resistencia que
tiene una gran potencia, la cual, dificulta, en cierta escala, la medida
correcta de las variaciones del pH, en este caso, la impedancia de la entrada y
la resistencia formada en el conjunto del medidor, forman una de las partes más
importantes de este, por lo que debido a ellas el resultado jamás sería exacto.
Portátiles: Son
muy exactos, compactos, funcionales y están elaborados con la mejor calidad,
tienen la gran ventaja de poder colocarse en cualquier lugar y de manipularse
en cualquier espacio del laboratorio o de la fábrica, son ideales para las
industrias farmacéuticas, los laboratorios y dentro del campo de la biología o
de la agricultura.
Componentes:
Memoria de lectura y capacidad de almacenamiento de cada una de las medidas
registradas, salida RS232, configuración manual o programada, unidades de
temperatura en °C o °F, programa automático de encendido y apagado, timer,
compensación de temperatura en modo automático.
Fijo:
Ideales para las fábricas, los laboratorios y para los procesos de producción
de los mismos, pues ofrecen un tipo de lectura en mv, en iones y en
temperatura, las opciones de mando son muy fáciles de ejecutar y son ideales
tanto para las empresas de pequeña producción que no requieren de un nivel de
logística y de producción demasiado complicadas, como para las grandes
industrias que generan toneladas de producción.
PH
DE LA FENOFTALEINA
Es un indicador de pH que en soluciones ácidas permanece
incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido
blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido
ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.
La fenolftaleína, de fórmula C20H14O4, es un
indicador de pH que en disoluciones ácidas permanece incoloro, pero
en disoluciones básicas toma un color rosado con un punto de viraje entre
pH=8,2 (incoloro) y pH=10 (magenta o rosado). Sin embargo, en pH extremos (muy
ácidos o básicos) presenta otros virajes de coloración: la fenolftaleína en
disoluciones fuertemente básicas se torna incolora, mientras que en
disoluciones fuertemente ácidas se torna naranja.
PH DEL TORNASOL
El Papel tornasol o Papel pH es utilizado para medir la
concentración de Iones Hidrógenos contenido en una sustancia o disolución.
Mediante la escala de pH, la cual es clasificada en distintos colores y
tipos. El papel tornasol se sumerge en soluciones y luego se retira para
su comparación con la escala de pH.
Escala de pH
- · 1 al 6 : Ácido
- · 7 : Neutro
- · 8 al 14 : Base o Alcalino
PH UNIVERSAL
Es una solución formada por una mezcla de compuestos que
presentan comportamiento de indicador ácido-base; permite medir la acidez o
alcalinidad de un medio con el cambio de color al cambiar el pH de la
disolución en un rango que va del 1 al 14. El cambio de color se debe a un
cambio estructural inducido por la protonación o desprotonación de la especie
de interés.
¿QUE ES TITULACIÓN?
La titulación, o también
conocida como valoración, tiene como objetivo determinar la concentración de
una disolución ácida o básica, llamada disolución analizada o muestra problema.
Esto se logra adicionando pequeños volúmenes de una disolución de concentración
conocida, llamada disolución valorada.
El proceso de titulación se
basa en la neutralización que se lleva a cabo entre la disolución ácida y la
básica. De esta manera, si se conoce la concentración de iones H+ de la
disolución valorada, se puede inferir la concentración de iones OH- de la
disolución analizada. Esto se calcula a partir del volumen de disolución
valorada utilizado.
En el momento en el que la
concentración de H+ y OH- se igualan, se dice que se ha alcanzado el punto de
equivalencia. Para determinar este punto, se utiliza un indicador que se
caracteriza porque tiene colores diferentes en medio ácido y en medio básico.
El punto en que cambia el color de un indicador se llama punto final. Por ende,
es necesario elegir un indicador cuyo punto final corresponda o se acerque lo
más posible al punto de equivalencia.
El proceso de titulación se
representa gráficamente mediante una curva de valoración. Para graficarla es
necesario saber el pH de la disolución analizada (eje Y) luego de la adición de
pequeñas cantidades de volumen de la disolución valorada (eje X).
Durante la titulación, el pH
de la disolución experimenta cambios que se pueden registrar de manera
experimental empleando un pH-metro o una cinta de pH, la última arroja
resultados menos exactos.
Por ejemplo, al titular 25 mL de NaOH de concentración
0,5M con HCl 0,5M del cual se disponen 10 mL, se debe conocer en primer lugar
la cantidad de moles de cada sustancia, teniendo en consideración que los moles
son iguales a la concentración molar por el volumen de solución.
Para determinar los moles de H+ se debe considerar que:
Moles H+ = Concentración de ácido x Volumen de ácido
Moles H+ = 0,5 mol/L x 0,01 L = 5 x 10-3 mol
Mientras que, para determinar los moles de OH-, se debe tener en cuenta que:
Moles OH- = Concentración de base x Volumen de base
Moles OH- = 0,5 mol/L x 0,025 L = 0,0125 mol
En este caso, considerando que los moles de ácido son menores que los moles de
la base, se debe poner la base en la bureta y el ácido en el matraz. Por lo
tanto, el pH de la muestra dependerá solo del ácido, cuando el volumen de la
base sea igual a 0 mL. En este caso, el pH será igual a:
pH = -log 5 x 10-3
pH = 2,30
Al agregar base a la solución, por ejemplo 1 mL, se añade en el matraz una
cantidad de moles específica que se calcula de la siguiente forma:
Si se añade 1 mL de base, los moles que se agregan a la muestra están dados
por:
moles de OH- = Concentración de base x Volumen de base
moles de OH- = 0,5 mol/L x 0,001 L = 5 x 10-4 mol
Estos moles de OH- reaccionan con los moles de H+ presentes en el matraz
formando agua. Por lo tanto, a los moles de ácido que inicialmente se tenían en
el matraz, se le debe restar el ácido añadido, ya que estos, han neutralizado
su efecto.
Moles de H+ = 5 x 10-3 mol – 5 x 10-4 mol = 4,5 x 10-3 mol
Al añadir 1 mL a la muestra, ahora la cantidad total de la muestra será 11 mL,
por lo tanto, la nueva concentración de la muestra estará dado por:
Concentración de ácido = moles de H+/Volumen de la muestra
Concentración de ácido = 4,5 x 10-3 mol / 0,011 L = 0,409 mol/L
A partir de esto, es posible, conocer el pH de la muestra, luego de haber
añadido la base, lo que estará dado por:
pH = -log 4,5 x 10-3
pH = 2,35
Por lo tanto, luego de añadir 1 mL de base a la muestra, la disolución aumento
su pH
MARCO DE DESARROLLO
-Pantallazos de sales
en Yenka
Ingresamos a la aplicación yenka y ponemos la carpeta de química
inorgánica.
Entrar en la carpeta de ácidos, sales y bases.
Seleccionamos neutralización.
A continuación comenzaremos a resolver la
actividad.
Aquí se mezcla el ácido clorhídrico más hidróxido de
sodio esto produce agua más cloruro de sodio.
Aquí se mezcla el ácido nítrico más hidróxido de
sodio que esto da agua más nitrato de sodio.
Aquí se mezcla ion sulfato ácido más ion sulfato más ion
hidrógeno ácido sulfúrico más hidróxido de potasio esto produce agua
más sulfato de potasio.
-Pantallazos del PH
en Yenka
Primero utilizamos fenolftaleína
Ahora pasamos a universal
Y seguimos con tornasol
-Pantallazos de titulación de
yenka
Web grafía



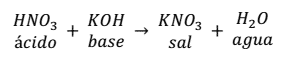
























LOS INFORMES ERAN POR SEPARADO FALTO MAS MARCO TEÒRICO 3,5
ResponderEliminar