CONSULTA
OXIGENO E
INTRODUCCIÓN
En este blog daré a conocer
el estado natural, las propiedades físicas, las propiedades químicas, la obtención,
reconocimiento y aplicaciones del hidrógeno y del oxígeno investigando en páginas
web, viendo vídeos, leyendo libros.
Es de gran importancia
reconocer e identificar los puntos mencionado anteriormente para así tener en
claro lo que vayamos a ver en clase.
OBJETIVOS
-Conocer el estado natural del oxígeno y también del
hidrógeno
-Saber las propiedades físicas
-Reconocimiento de los elementos
-Conocer las propiedades físicas
MARCO
OXIGENO
El
oxígeno es un elemento químico de aspecto incoloro con número atómico 8. Su
símbolo es O y pertenece al grupo de los no metales y su estado habitual en la
naturaleza es gaseoso. El oxígeno está situado en la posición 8 de la tabla
periódica.
ESTADO
NATURAL DEL OXÍGENO
El Oxígeno es el elemento más abundante
de la superficie terrestre, de la cual forma casi el 50%; constituye un 89% del
agua y un 23% del aire (porcentajes por pesos). En estado libre, el
oxígeno se encuentra en la atmósfera en forma de moléculas diatónicas (O2),
constituyendo un 23% por peso y un 21% por volumen. En combinación, entra en la
formación de una gran cantidad de compuestos orgánicos y minerales, haciendo
parte de todos los organismos animales y vegetales. De los minerales que
contienen oxígeno, los más importantes son los que contienen silicio, siendo el
más simple de toda la sílice (SiO2), que es el principal constituyente de la
arena. Otros compuestos que contienen oxígeno son sulfatos, carbonatos,
fosfatos, nitratos y óxidos, principalmente.
PROPIEDADES FÍSICAS DEL OXÍGENO
En condiciones
normales de presión y temperatura (STP), el oxigeno se encuentra en estado
gaseoso formando moléculas diatónicas (O2). Al igual que el
hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e
insípido.
El oxígeno se
condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC
en un sólido blando azulado. Para ambos estados de agregación es muy para magnético, es decir, sus regiones más probables de encontrar electrones u
orbitales tienden a alinearse paralelamente cuando están en presencia de un
campo magnético.
Si se suministra
energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxígeno
conocida como ozono, de acuerdo con la reacción siguiente:
3Oo (g)
→ 2O3 (g)
La estructura de
Lewis consideraba para el oxígeno presenta electrones sin pareja que violentan
la regla del octeto, pero justifican el carácter para magnético del oxígeno
molecular, de acuerdo al cual el oxígeno es atraído por un campo magnético,
tanto en su estado gaseoso como en estado líquido.
El ozono no es
magnético, por tanto se le considera una estructura en la cual todos los
electrones están apareados.
El ozono tiene un
olor fuerte y penetrante. Éste es más soluble en agua que el oxígeno debido a
que las moléculas del O3 son polares, sin embargo las del O2 no
lo son.
Si llevamos el
ozono a una temperatura de -111.5 oC se convierte en un líquido
azul intenso de carácter fuertemente explosivo. El ozono es un agente oxidante
fuerte. Sus aplicaciones se basan, precisamente, en su fuerte carácter
oxidante.
El ozono se usa
como germicida, como decolorante de ceras, féculas, grasas y barnices.
El oxígeno tiene
tres isotopos estables y diez radiactivos. Los radioisótopos tienen toda una
vida media de menos de tres minutos.
PROPIEDADES QUÍMICAS DEL OXIGENO
1. Es concurrente.
2. Reacciona con los no metales para formar óxidos ácidos o anhídridos.
3. Reacciona con los metales para formar óxidos básicos.
4. Reacciona con muchos de sus compuestos.
REACCIONES QUÍMICAS Y COMPUESTOS DEL OXIGENO.
2. Reacciona con los no metales para formar óxidos ácidos o anhídridos.
3. Reacciona con los metales para formar óxidos básicos.
4. Reacciona con muchos de sus compuestos.
REACCIONES QUÍMICAS Y COMPUESTOS DEL OXIGENO.
El oxígeno ocupa el segundo lugar dentro de la escala de electronegativo (EN). Éste forma compuestos con todos los elementos excepto los llamados metales nobles (oro, plata y platino), y los gases nobles (helio, neón y aparentemente el argón).
Las reacciones del
oxígeno con otros elementos pueden ser de tres tipos:
• Reacciones de
combustión. La reacción de combustión es la reacción del oxígeno del aire con
un material combustible, como lo son los hidrocarburos. Esta reacción es
axotérmica, lo que significa que genera gran cantidad de calor.
• Reacciones de oxidación.
La reacción de oxidación es la reacción del oxígeno del aire con cualquier
elemento de la tabla periódica, ya sea metálico o no metálico. Al producto de
una reacción de oxidación se llama óxido.
En este sentido,
existen dos tipos de óxidos:
Óxido Ácido o
Anhídrido: éste tiene lugar cuando un no metal se combina
con el oxígeno y obedece a la siguiente ecuación:
No metal +
oxígeno→ Óxido ácido anhídrido.
S + O2→
SO22 (dióxido de azufre)
C + O2→
CO2 (dióxido de azufre).
Óxido básico:
Este tiene lugar cuando un metal se combina con el oxígeno y obedece a la
siguiente educación:
Metal + Oxígeno→
Óxido básico.
4K+ O2→
2K O2 (Óxido de potasio).
Reacción con
algunos de sus compuestos:
2BaO + O2→
2Ba O2 (Peróxido de bario)
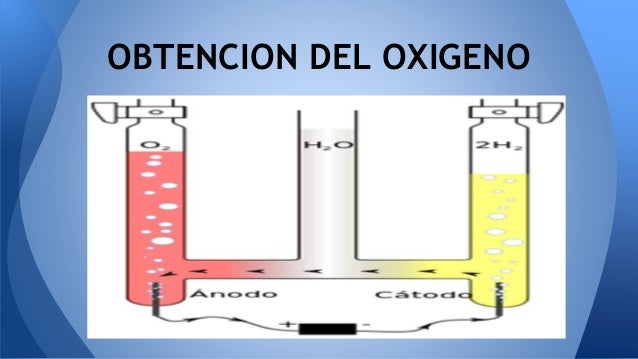
OBTENCIÓN DEL OXIGENO
El oxígeno industrial mente se puede obtener a partir de
la destilación fraccionada del aire líquido. En este procedimiento llamado método
de Georges Claude se desprende primero azoe a -193° y luego el oxígeno a -181°.
El aire está compuesto por:
Un método químico es el llamado método de Lavoisier el
que consiste en el calentamiento de mercurio se oxida a 360° y luego se
descompone el óxido.
Hg + O flecha HgO
En la industria se emplea el método de Boussingault, el
cual consiste en el calentamiento de barita u óxido de bario (BaO) que se
calienta al aire, al rojo naciente (400° aprox.), combinándose con el Oxígeno
para formar bióxido de bario.
BaO + O flecha BaO2
Calentando en seguida el bióxido de bario hacia 800°; se
disocia en barita y oxígeno por la reacción inversa.
BaO2 flecha BaO + O
Teóricamente la barita puede servir indefinidamente pero
en la práctica esto no sucede ya que el gas carbónico contenido en el aire
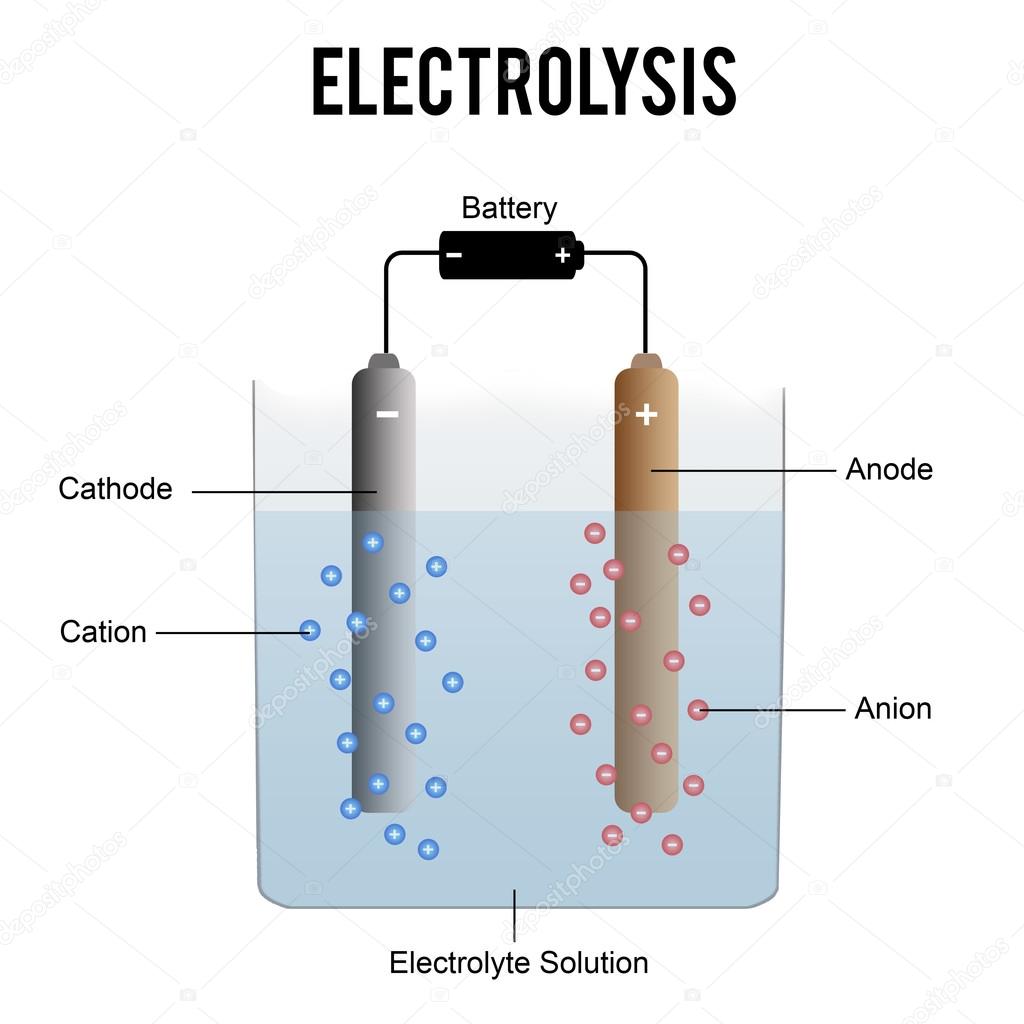
produce carbonato de bario y por esto se debe renovar la barita periódicamente.Se puede obtener oxígeno a partir de la
electrolisis de agua alcalinizada con un 10 o 15% de NaOH. Los electrodos
son de hierro. Todo se produce como si el agua estuviese descompuesta, y se
recoge el oxígeno en el electrodo positivo y el hidrógeno en el electrodo
negativo.
Métodos
de laboratorio: Se descompone el agua oxigenada en
presencia de un catalizador; se utiliza generalmente el bióxido de manganeso:
MnO2.
H2O2 flecha H2 O + O
En lugar de utilizar H2O2, se puede utilizar el compuesto
metálico correspondiente:
Na2O2 ó K2O2
Estos compuestos son destruidos por el agua:
H2O + K2O2 flecha 2KOH + O
Se puede obtener oxígeno por calcinación de bióxido de
manganeso y Clorato de potasio.
3MnO2 flecha Mn3O4 + O2
ClO3K flecha KCl + 3O
Realmente no se descompone el clorato de potasio
completamente sino hasta una temperatura mucho más elevada a una temperatura
moderada la ecuación correspondiente es la siguiente:
2ClO3K flecha ClO4K + KCl + O2
Para evitar este inconveniente generalmente se mezcla el
clorato de potasio con bióxido de manganeso, en el cual el oxígeno se fija
primero y luego inmediatamente lo abandona según las reacciones inversas:
2MnO2 + 3O flecha Mn2O7
Mn2O7 flecha 2MnO2 + 3O
RECONOCIMIENTO DEL OXIGENO
Es posible obtener oxígeno al mezclar dióxido de
manganeso con agua oxigenada; la reacción que se verifica es:
MnO2 (s)
2H2O2 (ac) --------------> O2 (g) + 2 H2O (l)
El test característico para reconocer oxígeno es acercar
al tubo donde se está produciendo el gas una pajuela encendida, con llama o
sólo con un brasa. La llama se avivará al instante, o el brasa se encenderá. Se
recomienda dejar un rato la reacción transcurrir antes de hacer el test, para
permitir que el oxígeno producido desplace al aire que se encuentra en el tubo.
APLICACIONES DEL OXIGENO
El
oxígeno tiene diversas múltiples funciones en nuestro mundo, desde algo tan
elemental como la respiración, hasta aplicaciones en la ciencia:
-Respiración: Las plantas y animales dependen del oxígeno para
respirar. Los humanos y animales inhalan oxígeno a los pulmones, o en el caso
de los anfibios, a través de las branquias o la piel. El oxígeno le da energía
a las células de la sangre antes de ser liberado como dióxido de carbono.
-En medicina: Suministrándolo como suplemento a pacientes con
dificultades respiratorias, el tratamiento no solo incrementa los niveles de
oxígeno en la sangre del paciente, sino que tiene el efecto secundario de
disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones
enfermos, facilitando el trabajo de bombeo del corazón. La oxigenoterapia se
usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas,
algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier
enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y
se emplean botellas de oxígeno en diversas prácticas deportivas como el
submarinismo o laborales, en el caso de acceder a lugares cerrados, o
escasamente ventilados, con atmósferas contaminadas.
-En cohetes: En su forma líquida, el oxígeno es usado como un agente
desoxidante en misiles y cohetes. El tanque exterior de gasolina que se usa
para elevar a una nave espacial fuera del atmósfera contiene cerca de 145.000
galones de oxígeno líquido (548 884 litros) y cerca de 390.000 galones de
hidrógeno líquido (1.476.310 litros). Los dos elementos reacciones en los
motores principales para generar un impulso máximo de 512.000 libras (232.239
kilos).
-Metalurgia: La producción del acero depende del oxígeno. Se usa en
un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el
óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de
corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los
sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados
centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.
-Ciencia: Los paleo climatólogos miden la relación entre el
oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos
marinos para determinar cómo era el clima hace millones de años. Las moléculas
de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan
a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12
% más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos
con una temperatura global más baja, la nieve y la lluvia procedentes de esa
agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua
marina que queda tiende a serlo en oxígeno-18. Los organismos marinos, por
tanto, incorporan más oxígeno-18 en sus esqueletos y exoesqueletos de lo que
harían en un medio más cálido. Los paleo climatólogos también miden
directamente esta relación en las moléculas de agua de muestras de núcleo de
hielo que se han conservado durante varios cientos de miles de años.
HIDRÓGENO
El hidrógeno es el
elemento químico más simple (formado solamente por un protón y un electrón) y
más abundante del universo. Se encuentra principalmente en forma de gas
hidrógeno (H2) en las estrellas y en los planetas gaseosos, y además aparece
unido a otros elementos formando gran variedad de compuestos químicos, como el
agua (H2O) y la mayoría de los compuestos orgánicos.
ESTADO NATURAL
Poco abundante. En el Universo, especie dominante. En la atmósfera en
estado libre y combinado. En la corteza terrestre como agua y en minerales.
Principal elemento de la vida por intervenir en la fusión nuclear en el
Sol y formar parte del agua y de moléculas orgánicas.
PROPIEDADES FÍSICAS
DEL
El hidrógeno es un gas incoloro, inodoro e
insípido. Poco soluble.
-Prop. Dependientes de las fuerzas
intermoleculares: bajos PF, PE y calores de cambio de estado
-Prop. Dependientes de la masa nuclear
*Densidad:
Como M es pequeña, d es baja
*Velocidad
de difusión: como M es pequeña, la velocidad es máxima.
-Prop. Dependientes del spin nuclear: dos formas isométrica.
El equilibrio depende de la temperatura.
*o−hidrógeno:
espines paralelos y mayor contenido energético. Se obtiene a partir del p−H2 usando Catalizadores.
*p−hidrógeno:
espines anti paralelos y mayor estabilidad. Se prepara pasando hidrógeno normal
por un tuvo con carbón vegetal a la temperatura del nitrógeno líquido.
PROPIEDADES QUÍMICAS DEL
-Pérdida de un e− de valencia:
EI elevada por el pequeño tamaño, puede ser compensado con la energía de
formación de una sustancia química.
-Ganancia de un e−:
La AE y la energía de formación de un enlace puede vencer la EI de elementos electropositivos.
-Compartición de e−:
Unión homopolar o heteropolar. La molécula de H2 es muy estable y muy difícil su
disociación, reactividad moderada.
Reacciones
del hidrógeno con los elementos químicos:
*Con bloque p: hidruros volátiles
*Con bloque s: hidruros salinos
*Con metales de transición: hidruros metálicos
*Con Be, Al, Ga, Sn, Pb: hidruros covalentes
*Con Cu, Zn, Cd: hidruros intermedios
OBTENCIÓN DEL
El hidrógeno se obtiene
mediante diversos procesos:
*Electrolisis
*Reformado
*Gasificación
*Ciclos termo químicos
*Producción biológica
-Electrolisis: La electrolisis es un proceso que consiste en la descomposición del agua a través de la utilización de la electricidad. Este proceso industrial tiene sus ventajas, pues es fácilmente adaptable ya sea para grandes o pequeñas cantidades de gas, consiguiéndose un hidrógeno de gran pureza. La electrolisis también posee la ventaja de poder combinarse y relacionarse de manera óptima con las energías renovables con el fin de producir H2.
*Electrolisis
*Reformado
*Gasificación
*Ciclos termo químicos
*Producción biológica
-Electrolisis: La electrolisis es un proceso que consiste en la descomposición del agua a través de la utilización de la electricidad. Este proceso industrial tiene sus ventajas, pues es fácilmente adaptable ya sea para grandes o pequeñas cantidades de gas, consiguiéndose un hidrógeno de gran pureza. La electrolisis también posee la ventaja de poder combinarse y relacionarse de manera óptima con las energías renovables con el fin de producir H2.
-Reformado: El reformado, consiste en la reacción de los
hidrocarburos con la presencia de calor y vapor de agua. Dicho método permite
producir grandes cantidades de hidrógeno con un bajo coste, partiendo del gas
natural. Como desventaja de éste método, podemos decir, que a pequeña escala no
es muy rentable ni comercial, y el hidrógeno producido suele contener
impurezas, siendo incluso en ciertas ocasiones necesaria la limpieza posterior,
o la realización de reacciones secundarias, con el fin de intentar purificar el
producto de hidrógeno. Se suele relacionar fácilmente con la fijación del CO2,
o almacenamientos de carbono, lo que hace que las emisiones del CO, incluido su
proceso de fijación, supongan un problema para este método, pues genera una
serie de costes adicionales.
-Gasificación: El hidrógeno a través del proceso de gasificación, se
obtiene a partir de hidrocarburos pesados y la biomasa, obteniéndose además del
hidrógeno, gases para reformado, a partir de las reacciones del vapor de agua y
el oxígeno.
Este método es muy adecuado cuando se trata de hidrocarburos a gran escala, pudiendo ser usados el carbón, los combustibles sólidos, y líquidos.
El hidrógeno obtenido por gasificación, presenta semejanzas con otros derivados sintéticos de la biomasa, produciendo competencia entre ellos. La gasificación de la biomasa es aún hoy en día objeto de estudio, y posee implicaciones y limitaciones pues necesita grandes extensiones de terreno.
Este método es muy adecuado cuando se trata de hidrocarburos a gran escala, pudiendo ser usados el carbón, los combustibles sólidos, y líquidos.
El hidrógeno obtenido por gasificación, presenta semejanzas con otros derivados sintéticos de la biomasa, produciendo competencia entre ellos. La gasificación de la biomasa es aún hoy en día objeto de estudio, y posee implicaciones y limitaciones pues necesita grandes extensiones de terreno.
-Ciclos termo químico: Este proceso utiliza el calor de bajo coste producido
de la alta temperatura que procede de la energía nuclear o también de la
energía solar concentrada.
Es un proceso bastante utilizable y atractivo cuando se habla de gran escala, al tener bajo coste económico, y no emitiendo gases de carácter invernadero, pudiendo ser usado en la industria pesada o incluso en el transporte. Existen distintos proyectos de colaboraciones internacionales para investigar y desarrollar este método. Hoy en día, aún falta mayor investigación sin fines comerciales.
Es un proceso bastante utilizable y atractivo cuando se habla de gran escala, al tener bajo coste económico, y no emitiendo gases de carácter invernadero, pudiendo ser usado en la industria pesada o incluso en el transporte. Existen distintos proyectos de colaboraciones internacionales para investigar y desarrollar este método. Hoy en día, aún falta mayor investigación sin fines comerciales.
RECONOCIMIENTO DEL HIDRÓGENO
La producción de
hidrógeno es un procedimiento muy simple y corresponde a una reacción
característica: se sumerge un trozo de zinc en una solución de ácido
clorhídrico no muy diluida. La reacción que se produce es:
Zn (s) +2 HCl (ac) --> ZnCl2 (ac) + H2 (g)
(es posible realizar la reacción análoga con magnesio, Mg)
El test característico para reconocer hidrógeno corresponde a acercar al tubo donde se está produciendo este gas un fósforo encendido; al tomar contacto con el hidrógeno ocurre una explosión muy pequeña que apaga la llama del fósforo.
APLICACIONES DEL HIDRÓGENO
-Reducción de óxidos metálicos en metalurgia
-Síntesis química: Producción de amoniaco por el procedimiento de Haber
-Fabricación de metanol para combustible
-Fabricación de HCl de elevada pureza
-Hidrogenación de compuestos orgánicos insaturados: aceites vegetales
para margarinas comestibles o hidrocarburos insaturados para aceites
lubricantes.
-Producción de elevadas temperaturas: Soplete oxhídrico (2000ºC)
-Soplete de hidrógeno atómico (Langmuir) 4000ºC)
-Como combustible: almacenado usando una aleación metálica. Tiene como
ventajas una mayor
WEB
ESTADO NATURAL DEL OXIGENO
PROPIEDADES FISICAS DEL OXIGENO
PROPIEDADES QUIMICAS DEL OXIGENO
OBTENCION DEL OXIGENO
RECONOCIMIENTO DEL OXIGENO
ESTADO NATURAL DEL HIDROGENO
PROPIEDADES FISICAS DEL HIDROGENO
PROPIEDADES QUIMICAS DEL HIDROGENO
OBTENCION DEL HIDROGENO
RECONOCIMIENTO DEL HIDROGENO














EN INFORME DE GASES FALTARON EJERCICIOS 4.5
ResponderEliminar